Перевод из
Schalm’s veterinary hematology. – 6th ed.
Сокращения и аббревиатуры
Bmp, костный морфогенетический белок; 2,3 - DPG, 2,3 - дифосфоглицерат;
E#, день эмбрионального развития, где число указывает возраст эмбриона в днях после зачатия;
EPO, эритропоэтин;
fL, фемтолитр;
Gata1, 2 и 4, GATA - связывающие белки 1, 2 и 4;
HSC, гемопоэтические стволовые клетки;
Ihh, индийский еж;
IL, интерлейкин;
P#, день постнатального развития, где число указывает возраст новорожденного в днях после родов; pg, пикограмм;
PU.1, пуриновый бокс - связывающий фактор транскрипции;
Scl/Tal - 1, лейкоз стволовых клеток/T - фактор острого лейкоза.
ОСНОВНЫЕ ПРИНЦИПЫ РАЗВИТИЯ ГЕМОПОЭТИЧЕСКОЙ СИСТЕМЫ
Клетки крови, вырабатываемые на разных стадиях развития, различаются по морфологии и функциям. Таким образом, примитивные («фетальные») клетки, вырабатываемые на ранних стадиях гестации, имеют заметно отличающиеся свойства от своих окончательных («взрослых») аналогов, вырабатываемых на поздних стадиях гестации и в постнатальной жизни. Этот принцип наиболее полно охарактеризован в клетках эритроидной линии. Примитивные эритроциты (эритроциты) образуются в желточном мешке, тогда как окончательные эритроциты вырабатываются печенью, а затем селезенкой и костным мозгом. Примитивные эритроциты образуют ядра в кровотоке примерно до 12,5 дня (E12.5) беременности, после чего ядра постепенно конденсируются, прежде чем будут сброшены между E14.5 и E16.5. Энуклеированные примитивные эритроциты сохраняют свой большой размер и могут оставаться в кровотоке вплоть до 5-го дня после рождения (P5). Как примитивные, так и дефинитивные эритроциты высвобождаются в течение большей части второй половины беременности (с E10 по E18), хотя соотношение меняется с течением времени от преимущественно примитивных к преимущественно дефинитивным эритроцитам.
Примитивные и дефинитивные эритроциты можно различить по их размеру. Объем примитивных эритроцитов варьируется от 465 до 530 фемтолитров (fL), что примерно в шесть раз больше, чем у дефинитивных эритроцитов. Содержание гемоглобина в примитивных эритроцитах, от 80 до 100 пикограмм (пг)/клетку, также почти в шесть раз превышает количество, обнаруженное в дефинитивных эритроцитах. Как примитивные, так и дефинитивные эритроциты имеют базофильную цитоплазму, когда они впервые производятся из-за обильного шероховатого эндоплазматического ретикулума, но базофилия отступает по мере достижения максимального содержания гемоглобина.
ПРИМИТИВНЫЙ ГЕМОПОЭЗ
Эритроидные клетки
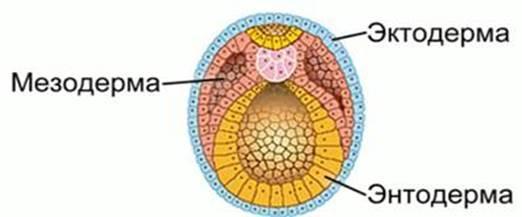
Гемопоэз происходит в нескольких местах внутри эмбриона и во внеэмбриональных тканях. Первая фаза производства клеток крови, называемая примитивным гемопоэзом, отвечает за выработку элементов крови на самой ранней стадии эмбриогенеза. Примитивный гемопоэз происходит в висцеральном желточном мешке, начиная примерно с E7.0. Таким образом, примитивные гемопоэтические клетки являются одними из самых ранних отдельных тканей, которые дифференцируются в эмбрионе. Образование примитивных клеток быстро снижается после E11. Висцеральный желточный мешок или внеэмбриональная спланхноплевра (термин для структуры, в которой мезодерма и энтодерма непосредственно противопоставлены) возникает в результате миграции внеэмбриональной мезодермы, текущей из каудальной первичной полоски вдоль внутренней поверхности висцеральной энтодермы. Мезодермальные клетки, призванные инициировать и поддерживать кроветворение, были названы гемангиобластами, поскольку смежность примитивного кроветворения и васкулогенеза как в пространстве, так и во времени предполагает, что примитивные кроветворные и эндотелиальные клетки в желточном мешке имеют общего предка. Гемангиобласты возникают как недифференцированные клетки на стадии примитивной полоски и обязуются производить определенную клеточную линию до образования кровяных островков. Эти плюрипотентные клетки также могут дифференцироваться в другие ткани, происходящие из мезенхимы.
Между E7.5 и E9.0 гемангиобласты образуют множественные агрегаты, называемые кровяными островками. Каждый кровяной островок содержит центральное ядро из неприкрепленных внутренних гемангиобластов (кроветворных предшественников), окруженное ободом из веретенообразных внешних гемангиобластов (эндотелиальных предшественников). Ядросодержащие эритроидные клетки впервые распознаются в ядрах кровяных островков на E8.0 и становятся очевидными в циркуляции в сердечно-сосудистой системе, начиная с E8.25. На этой стадии эмбриональные эритробласты попадают в кровообращение, где они продолжают делиться примерно до E13.0.
Большинство клеток, образующихся во время примитивного кроветворения, относятся к эритроидной линии. Приверженные эритроидные колониеобразующие клетки поступают в желточный мешок примерно на E7.25. Эти клетки расширяются до E8.0, а затем дифференцируются в примитивные эритробласты; все колониеобразующие клетки полностью регрессируют к E9.0,34 что примерно соответствует самой ранней фазе дефинитивного эритропоэза. Примитивные эритробласты служат единственным источником эритроцитов у раннего эмбриона с E8.0 до примерно E10.534 и остаются важным источником эритроцитов до E13. Таким образом, эмбрионы с возрастом развития между E8.0 и E11, страдающие анемией, страдают дефектом примитивного эритропоэза. Интересно, что кажущиеся глубокими дефекты примитивного кроветворения, приводящие к стойким функциональным нарушениям во взрослом возрасте, могут и не вызывать аномального гематологического профиля у эмбриона.
Другие клетки
Недавние исследования показывают, что другие линии гемопоэтических клеток также генерируются в желточном мешке во время этой примитивной стадии развития кроветворения. Примитивные лимфоидные предшественники и даже некоторые взрослые стволовые клетки развиваются на E7.5 и впоследствии засеивают другие места кроветворения, включая область аорты - гонады - мезонефроса (AGM), пупочные сосуды и печень. Примитивные макрофаги были идентифицированы в желточном мешке на E8.0 4 - E9.0. Эксперименты in vitro продемонстрировали, что клетки желточного мешка E7.5 могут давать начало функциональным мегакариоцитарным предшественникам на E10.5. Многие гемангиобласты фактически служат би- или олиго-потентными предшественниками, включая те, которые способны к приверженности эритроцитарно-миелоидным, эритроцитарно-мегакариоцитарным, гранулоцитарно-макрофагальным и лимфоидным (В-клетки и Т-клетки)/миелоидным линиям. Также сообщалось, что стволовые клетки для тучных клеток возникают в желточном мешке во время примитивного кроветворения.
ДЕФИНИТИВНЫЙ ГЕМОПОЭЗ
Независимо от их исходного места синтеза de novo, HSC мигрируют в другие места, которые поддерживают дефинитивный гемопоэз: эмбриональная печень, затем эмбриональный тимус, фетальная селезенка и костный мозг (в этом порядке). Эти последние места назначения не производят HSC de novo, а скорее содержат ниши, подходящие для расширения вновь прибывших HSC. Пригодность таких ниш контролируется специфическими характеристиками их стромальных поддерживающих клеток. Эмбриональная печень колонизируется первой, по-видимому, потому, что она разделяет многие молекулярные и функциональные сходства с желточным мешком. Она обеспечивает основной локус для дефинитивного гемопоэза с E12 по E16. HSC попадают в эмбриональную печень несколькими последовательными волнами между E9.0 или E10.0 и E12. Первые HSC, попавшие в печень, являются плюрипотентными и могут образовывать любой тип гемопоэтических клеток. Их первым шагом во внутрипеченочном созревании является приверженность более ограниченному диапазону вариантов линий, как правило, как эритромиелоидный предшественник или общий миелолимфоидный предшественник. Окончательные эритроидные предшественники созревают и энуклеируются в эритроидных островках в печени перед тем, как попасть в кровоток. Миелолимфоидные предшественники, полученные из печени, впоследствии развиваются в бипотентные клетки (В-клетки и миелоидные или Т-клетки и миелоидные), прежде чем приступить к производству одной клеточной линии. Некоторые предшественники Т-клеток имеют бипотентную приверженность к линии NK-клеток. Предшественники Т-клеток, предназначенные для переноса в эмбриональный тимус, вырабатываются даже у бестимусных мышей, что указывает на то, что фетальная печень может играть роль в содействии ранней дифференцировке Т-клеток.
Эмбриональный тимус и фетальная селезенка засеваются либо из печени, либо из AGM, либо из обоих, начиная примерно с E13 для тимуса и с E15 для селезенки. Тимус обычно принимает только те HSC, которые предназначены для производства Т-клеток, тогда как другие мультипотентные миелолимфоидные элементы направляются в другие места. Количество предшественников Т-клеток в печени обильно на E12, но затем уменьшается, тогда как популяция внутрипеченочных предшественников В-клеток демонстрирует обратную тенденцию. Большинство типов дефинитивных гемопоэтических клеток в селезенке возникают из клеток-предшественников, которые предназначены для определенной линии перед тем, как покинуть печень. Мультипотентные HSC, попадающие в селезенку, прекращают пролиферацию и дифференцируются в зрелые макрофаги. Эти клетки могут регулировать внутриселезеночный эритропоэз.
Костный мозг впервые получает HSC из печеночных депо примерно на E16. После этого распределение колониеобразующих гемопоэтических предшественников смещается от преимущественно гепатоцентрической локализации на E18 через более дисперсное распределение (костный мозг, печень и селезенка примерно в равных количествах) на P2 к профилю, благоприятствующему костному мозгу и в меньшей степени селезенке на P4 и позже. Таким образом, костный мозг, печень и селезенка функционируют совместно, регулируя окончательный гемопоэз. Во время сотрудничества каждый орган поддерживает молекулярно отличную подгруппу гемопоэтических предшественников.
Активные гемопоэтические клетки-предшественники необходимы для развития всех типов клеток крови, наблюдаемых у взрослых животных. Эти клетки образуются в ходе дефинитивного кроветворения, которое представляет собой процесс образования клеток крови в костном мозге. Гемопоэтические стволовые клетки (HSC), полученные из области AGM, участвуют во всех основных линиях клеток крови, включая эритроидные (красные кровяные тельца), лимфоидные (В- и Т-клетки) и миелоидные (гранулоциты, моноциты, макрофаги) клетки. Популяция HSC, полученная из плаценты, поддерживает выработку эритроцитов, В- и Т-лимфоцитов и миелоидных клеток. В отличие от этого, HSC, полученные из желточного мешка, способствуют образованию только лимфоидных и миелоидных типов клеток. Еще предстоит определить, проявляют ли предшественники определенных линий клеток крови различные функциональные и молекулярные характеристики на поздних стадиях внутриутробной и послеродовой жизни.
Эмбрионы поздней стадии (E13–E15), плоды (E16 до рождения) и новорожденные, у которых проявляется анемия, страдают дефектом дефинитивного эритропоэза. Аномалии, связанные с этим проявлением, включают полное отсутствие дефинитивного кроветворения и неспособность клеток-предшественников должным образом колонизировать внутриэмбриональные участки кроветворения. Могут быть затронуты множественные клеточные линии; такой комбинированный эффект предполагает, что гемопоэтический дефект возникает в би- или мультипотентной стволовой клетке, а не в той, которая предназначена для формирования определенной клеточной линии. Проявление анемии поздней стадии также может быть результатом общей задержки роста и развития, а не целенаправленной аномалии в эритроцитарной линии.
У молодых животных количество циркулирующих кровяных клеток отличается от количества взрослых. Количество эритроцитов увеличивается более чем вдвое между рождением и ранней взрослой жизнью. Количество циркулирующих лейкоцитов при рождении составляет приблизительно 20% от уровня взрослых, а затем увеличивается до взрослого уровня к 6–7 неделям. Количество тромбоцитов у новорожденных составляет приблизительно одну треть.
ТРАНСФОРМАЦИЯ ГЕМОГЛОБИНА
Степень экспрессии отдельных генов глобина и сочетание экспрессируемых генов глобина со временем меняются. Например, энуклеированные примитивные эритроциты содержат относительно больше β min, чем дефинитивные эритроциты. На E11.5 β min составляет приблизительно 80% β-глобина в кровотоке. Этот уровень снижается приблизительно на 60% при рождении. Примитивные эритроциты экспрессируют увеличивающиеся уровни взрослых глобинов по мере развития беременности, тогда как дефинитивные эритроциты содержат только варианты взрослых белков. Эта эволюция указывает на то, что характер экспрессии глобина переключается по мере замены примитивных эритроцитов дефинитивными эритроцитами. Молекулярные механизмы, которые регулируют процесс переключения, сложны. Время этого переключения между E10.5 и E12.5 совпадает с первоначальным подъемом дефинитивного эритропоэза. Нарушение синхронизации этого переключения характерно для некоторых моделей заболеваний кроветворной системы на мышах.
Успешное поддержание развивающегося зародыша зависит от преимущественного захвата кислорода в эмбриональных и фетальных тканях. Поэтому примитивные эритроциты, как правило, имеют более высокое сродство к кислороду, чем материнские эритроциты, хотя домашние кошки являются исключением. Эта секвестрация кислорода опосредована двумя основными механизмами. Механизм, относящийся к раннему эмбриональному периоду, заключается в большем сродстве эмбрионального гемоглобина в примитивных эритроцитах к кислороду по сравнению с гемоглобином взрослого организма. С другой стороны, дефинитивные эритроциты в позднем эмбрионе и плоде обладают более низкой концентрацией 2,3-дифосфоглицерата (2,3-DPG), чем материнские эритроциты. Более высокие уровни 2,3-DPG облегчают высвобождение кислорода в ткани. После рождения уровни содержания 2,3-DPG в эритроцитах повышаются до уровней взрослых в течение 10-15 дней.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ, РЕГУЛИРУЮЩИЕ РАЗВИТИЕ КРОВЕТВОРЕНИЯ
Секретируемые молекулы также являются важными регуляторами развития кроветворения во время беременности. Например, эритропоэтин (EPO) поддерживает как примитивный, так и дефинитивный эритропоэз, стимулируя пролиферацию и дифференциацию незрелых примитивных и дефинитивных эритроцитов. Снижение активности EPO в желточном мешке значительно снижает количество колониеобразующих клеток и эритробластов посредством чрезмерного апоптоза. Тромбопоэтин выполняет аналогичную функцию для мегакариоцитов, хотя также требуются другие цитокины (интерлейкин-3 [ИЛ-3], ИЛ-6) и факторы роста (гранулоцитарный колониестимулирующий фактор, фактор стволовых клеток). Другие сигнальные пути лиганда/рецептора, которые, как показано, влияют на развитие кроветворения, включают молекулу индийского ежа (molecule Indian hedgehog) (Ihh), полученную из эндодермы, и костный морфогенетический белок 4 (Bmp4), оба из которых участвуют в образовании кровяных островков и васкулогенезе в желточном мешке. В целом, секретируемые молекулы действуют посредством взаимодействия со специфическим фактором транскрипции
Молекулы клеточной адгезии семейства интегринов необходимы для правильной миграции гемопоэтических предшественников. Например, β1 - интегрины необходимы для того, чтобы HSC достигали печени эмбриона, а затем селезенки и костного мозга плода на соответствующих стадиях развития.Потеря β1 - интегринов предотвращает адгезивное взаимодействие между HSCs и эндотелиальными клетками, тем самым блокируя HSCs в сосудах.Некоторые интегрины выполняют дополнительные функции, помимо своей целевой функции. Потеря β1 - интегринов предотвращает адгезивное взаимодействие между HSCs и эндотелиальными клетками, тем самым блокируя HSCs в сосудах.Некоторые интегрины выполняют дополнительные функции, помимо своей целевой функции. Например, β4 - интегрины необходимы не только для правильного самонаведения, но и для размножения и дифференцировки предшественников эритроидных и В-клеток в печени, селезенке и костном мозге. Как и в случае с секретируемыми факторами, активность некоторых интегринов в большей степени относится к поздним срокам беременности и неонатальным стадиям, а не к более ранним стадиям развития кроветворения. Эта хронология была задокументирована для β4 - интегрина в отношении лимфоидной и миелоидной дифференцировки.
Сокращения и аббревиатуры
RBC — эритроцит;
WBC — белые кровяные клетки.
функциональные взаимоотношения между различными компонентами костного мозга. Более подробное обсуждение биохимического и молекулярного контроля кроветворения и кроветворной микросреды читатель может найти в главах 1 и 5.
ПОДДЕРЖИВАЮЩИЕ СТРУКТУРЫ
Слой эндостальных клеток толщиной от одной до двух клеток с тонким слоем соединительной ткани выстилает все костные поверхности внутри костномозговой полости. Этот слой иногда перемежается остеобластами и остеокластами костной ткани и может быть пересечен эндостальными кровеносными сосудами, соединяющими кроветворное пространство с костью. Остеобласты участвуют в образовании костной ткани и происходят из мультипотентных мезенхимальных стромальных клеток-предшественников, которые также дают начало стромальным клеткам костного мозга и адипоцитам. Остеокласты - это многоядерные клетки, происходящие из слившихся моноцитарно- макрофагальных предшественников под влиянием многочисленных сигналов, в том числе исходящих от остеобластов. Остеобласты и остеокласты реконструируют кость в пространстве костного мозга, влияя на эндостальную среду и, вероятно, способствуя регуляции пролиферации гемопоэтических стволовых клеток и их транспортировке. Остеобласты и остеокласты также продуцируют кроветворные цитокины, и взаимодействие между костью и кроветворными клетками может влиять на обновление и ремоделирование костной ткани.
Тонкие, веретеновидные или звездчатые стромальные клетки распространяются от эндостальных областей в паренхиму кроветворной ткани. Эти клетки, вероятно, происходят из фибробластов костного мозга и образуют поддерживающую сеть для кроветворных клеток, жировой ткани и кровеносных сосудов. Стромальные клетки вырабатывают растворимые факторы, которые способствуют регуляции кроветворения, и взаимодействуют с кроветворными клетками-предшественниками посредством прямого межклеточного контакта. Стромальные клетки костного мозга вырабатывают структурные фибриллы, такие как коллаген, ретикулин, ламинин и фибронектин, а также основное вещество, состоящее из воды, солей, гликозаминогликанов и гликопротеинов, которые в совокупности называются внеклеточным матриксом. Как и поддерживающие клеточные структуры костного мозга, внеклеточный матрикс участвует как в структурной, так и в биохимической поддержке кроветворения.
Костный мозг содержит преимущественно коллаген I и III типов, которые принимают свою окончательную форму после секреции во внеклеточное пространство, где они подвергаются ферментативной модификации. Ретикулин отличается от коллагена в костном мозге наличием тонких аргирофильных волокон, которые состоят из ядра коллагена I типа, окруженного волокнами коллагена III типа, встроенными в матрицу гликопротеинов и гликозаминогликанов. Хотя тонкая соединительнотканная структура костного мозга не видна на обычно обрабатываемых гистологических срезах, специальные окраски могут улучшить ее визуализацию. Коллаген можно визуализировать с помощью трихромного окрашивания по Маллори или Массону, тогда как серебряное окрашивание по Гомори выявляет наличие ретикулина. Это может быть важно при патологических состояниях, при которых избыточная выработка матриксного материала способствует возникновению заболевания. Дифференциация коллагенового и ретикулинового фиброза может иметь диагностическое значение и влиять на вероятность обратимости поражения. Расширенный внеклеточный матрикс характерен и для других заболеваний костного мозга, выходящих за рамки классических синдромов миелофиброза.
Жировая ткань, перемежающаяся с кроветворной тканью, опутана одними и теми же опорными структурами. Связь между образованием костной и жировой ткани до конца не изучена. Адипоциты, вероятно, происходят из тех же мезенхимальных предшественников, которые производят стромальные клетки и остеобласты, и имеются некоторые доказательства взаимопревращения клеток, происходящих из комитированных остеобластических и адипогенных линий, полученных из популяции мезенхимальных предшественников. Адипоциты — самые многочисленные стромальные клетки костного мозга. У здоровых животных жировая ткань занимает примерно от 25% до 75% объема костного мозга в зависимости от возраста животного. Жировая ткань также содержит
другие типы клеток, которые менее заметны, чем адипоциты, на обычных гистологических срезах. Эти клетки также вносят вклад в структурную и функциональную роль жировой ткани в кроветворении и включают эндотелиальные клетки, макрофаги и клетки-предшественники адипоцитов. В костном мозге присутствует как бурая, так и белая жировая ткань; Различия в биологической функции этих типов жиров до конца не изучены. Жировая ткань костного мозга, как правило, относительно устойчива к липолизу во время голодания по сравнению с жировой тканью в других частях тела.
Помимо обеспечения структурной поддержки, жировая ткань также может участвовать в кроветворной микросреде. Клетки, полученные из жировой ткани костного мозга, способны поддерживать дифференцировку кроветворных предшественников in vitro. Важны также эндокринные и паракринные функции жировой ткани. Адипокины — биологически активные вещества, вырабатываемые жировой тканью, включают регуляторы кроветворения и иммунного ответа.
СОСУДИСТАЯ СЕТЬ И СТРОЕНИЕ СИНУСОВ

обзор. Exp Hematol 1981;9:391 – 410, с
разрешение.)
Кроветворение происходит во внесосудистых пространствах между венозными синусами и имеет тесную морфологическую и функциональную взаимосвязь с клетками, выстилающими венозные синусы. Венозные синусы выстланы полным просветным слоем широких плоских эндотелиальных клеток и неполным наружным слоем аблуминальных ретикулярных клеток (рис. 2.2). Ретикулярные клетки поддерживают тесные физические связи с гемопоэтическими клетками, расположенными вблизи стенок синуса, часто обволакивая или иным образом контактируя с гемопоэтическими предшественниками. Базальная пластинка между синусоидами и кроветворным пространством тонкая и прерывистая, что облегчает попадание зрелых кроветворных клеток в кровоток. Эндотелиальные клетки синуса могут регулировать перемещение клеток и других веществ в системный кровоток. Ультраструктурно эндотелиальные клетки синуса имеют четкие клеточные соединения, которые не являются плотными, и наблюдался выход гемопоэтических клеток через миграционные поры в эндотелиальных клетках. Другие твердые частицы могут проникать в эндотелиальные клетки синуса в процессе эндоцитоза.
ИННЕРВАЦИЯ
Синусоидальная система менее богата иннервацией, чем артериальная сосудистая сеть, при этом нервные окончания часто контактируют со стенками синусоидов. Другие нервные волокна, по-видимому, заканчиваются в пределах кроветворной материнской клетки.
химусе или вдоль эндоста. Неясно, существует ли общая или раздельная иннервация костной и кроветворной ткани, хотя по крайней мере некоторые нервные волокна в костном мозге, по-видимому, происходят из минерализованной кости. Костный мозг содержит эфферентные норадренергические и пептидергические симпатические и предполагаемые чувствительные нервные волокна. Имеются некоторые данные о том, что сигналы симпатической нервной системы могут способствовать регуляции кроветворения, иммунной функции и миграции гемопоэтических стволовых клеток.

КЛЕТОЧНАЯ ОРГАНИЗАЦИЯ
Гемопоэтические клетки происходят из общей плюрипотентной стволовой клетки, которая дает начало лимфоидным и миелоидным клеткам-предшественникам. Лимфоидные клетки-предшественники генерируют потомство лимфоцитов, тогда как миелоидные клетки-предшественники генерируют эритроидные клетки, мегакариоциты, базофилы, эозинофилы и общую гранулоцитарно-макрофагальную клетку, которая продуцирует нейтрофилы и макрофаги. Каждая клеточная линия демонстрирует пирамидальную прогрессию числа клеток, при этом наименее зрелые клетки представлены в наименьшем количестве, а клетки на последующих стадиях развития представлены в возрастающих пропорциях.
Мегакариоциты
Развитие мегакариоцитов начинается с мегакариобласта, прогрессирует до промегакариоцитов и базофильных мегакариоцитов и завершается образованием зрелых мегакариоцитов. Предшественники мегакариоцитов постепенно увеличиваются по мере дифференциации, становясь самой крупной клеткой в костном мозге. Их ядра созревают из одного ядра в большое многодольчатое ядро посредством процесса, называемого эндомитозом, который представляет собой репликацию ДНК без клеточного деления. Цитоплазма ранних предшественников мегакариоцитов сканируется и становится глубоко базофильной, становясь более обильной, слегка базофильной и заполненной многочисленными эозинофильными гранулами по мере созревания клетки.
По мере созревания мегакариоциты мигрируют к венозным синусам и могут составлять часть слоя эндотелиальных клеток. Такое расположение позволяет цитоплазматическим отросткам распространяться через эндотелиальные щели и выбрасывать протромбоциты непосредственно в просвет синуса. Тромбоциты высвобождаются из протромбоцитарных отростков в периферическое кровообращение (см. Главу 9).
Эритробластические (рубробластические) островки
Стадии эритропоэза включают рубробласты, прорубрициты, рубрициты, метарубрициты, ретикулоциты и зрелые эритроциты (см. Главу 6). По мере созревания эритроидных предшественников клетки становятся меньше, ядерно-цитоплазматическое соотношение уменьшается, цитоплазма становится менее базофильной и более полихроматофильной, а ядерный хроматин уплотняется. У млекопитающих ядро выдавливается перед созреванием в зрелую клетку. Эритропоэз происходит в отдельных эритробластических островках (рис. 2.3), которые представляют собой скопления клеток, которые иногда можно наблюдать в цитологических образцах костного мозга. Эритробластические островки образуются вокруг центрального макрофага, который проецирует мембранные отростки для содействия эритропоэзу, обеспечивая железом и, вероятно, другими питательными веществами и гемопоэтическими цитокинами. Эти макрофаги также фагоцитируют вытесненные ядра и дефектные клетки. Эритроидное потомство находится в концентрических кругах, окружающих центральный макрофаг, а более молодые формы находятся ближе к макрофагу. Центральные макрофаги набираются из подгруппы резидентных макрофагов, полученных из предшественников моноцитов. Эритробластические островки расположены вблизи венозных синусов. Недавнее исследование эритропоэза в костном мозге крыс предполагает, что эритробластические островки подвижны и мигрируют к синусоидам по мере созревания, и что эритробластические островки состоят из клеток на схожих стадиях развития эритроидов.

Компартментализация или компартментация - разделение клеток эукариот на отсеки (компартменты), покрытые оболочкой из бислоя липидов (т.е. отделенные мембраной), в которых локализованы определенные биохимические процессы. Примерами компартментов могут быть митохондрии, хлоропласты, пероксисомы, лизосомы, эндоплазматический ретикулум, ядро клетки и аппарат Гольджи.
Сокращения и аббревиатуры
ОПРЕДЕЛЕНИЕ СТВОЛОВЫХ КЛЕТОК
Характеристики
Стволовые клетки представляют собой популяцию неспециализированных клеток-предшественников, которые обладают способностью к самообновлению и способностью к дифференцировке, что приводит к образованию зрелых клеток и тканей. Последняя функция отчетливо проявляется в эмбриональных стволовых клетках (EPC), поскольку они приводят к образованию многочисленных различных клеток и тканей зрелого организма. Небольшое количество стволовых клеток сохраняется на протяжении всей жизни в виде взрослых стволовых клеток и является резервуаром для замены короткоживущих клеток или регенерации поврежденных тканей. Гемопоэтические стволовые клетки (HSC) являются резервуаром для замены клеток крови и присутствуют с частотой 1 на каждые 10 000–100 000 клеток крови. (рис. 3.1; см. главы 6–10).
При определении стволовых клеток используются две общие функциональные характеристики. Первая из них — способность к долгосрочному самообновлению. Стволовые клетки обладают способностью посредством митотического деления поддерживать популяцию недифференцированных клеток в пуле стволовых клеток в течение месяцев и лет на протяжении многих циклов клеточного деления. При делении стволовых клеток в среднем одна дочерняя клетка является репликой и остается в недифференцированном состоянии, тогда как вторая дочерняя клетка запрограммирована на дифференциацию. Такое образование двух дочерних клеток с разными свойствами называется асимметричным делением клетки. Вторая характеристика стволовых клеток — способность образовывать дифференцированные или специализированные типы клеток.
Потентность — это термин, который используется для описания степени или масштаба, в котором могут быть сформированы множественные функциональные клеточные линии. Тотипотентные стволовые клетки — это клетки, способные формировать целые организмы, включая дополнительные эмбриональные ткани (например, плаценту). Этот тип стволовых клеток может быть получен из зиготы или раннего бластомера. Плюрипотентные стволовые клетки способны образовывать все типы клеток организма (например, эмбриональные стволовые клетки). Мультипотентные стволовые клетки генерируют все дифференцированные клетки определенной линии (например, ГСК) и будут представлять особый интерес для тем этого текста. Наконец, унипотентные стволовые клетки дают начало только одной клеточной линии (например, сперматогониальным стволовым клеткам).

Тесты и маркеры
Функциональные анализы, демонстрирующие плюрипотентную или мультипотентную природу стволовых клеток, были проведены с помощью in vitro формирования эмбриональных тел, in vivo генерации тератом у мышей с тяжелым комбинированным иммунодефицитом (SCID, severe combined immunodefi ciency) после трансплантации ESC (эмбриональных стволовых клеток) и, в случае HSC (гемопоэтических стволовых клеток), репопуляции кроветворной системы летально облученных мышей после трансплантации неочищенных клеток, полученных из костного мозга. Однако способность идентифицировать и изолировать стволовые клетки во многом зависит от использования различных маркеров, таких как поверхностные молекулы, факторы транскрипции и отток красителя. Для идентификации плюрипотентных клеток и стволовых клеток в определенных типах тканей доступны многочисленные маркеры, которые часто используются в комбинации. Хотя некоторые маркеры и тесты используются более универсально для распознавания стволовых клеток, особое внимание будет уделено тем, которые используются для идентификации стволовых клеток, полученных из костного мозга.
Кластер дифференциации (CD)34
CD34 — это гликопротеин клеточной поверхности, который традиционно используется для идентификации и очистки HSC и клеток-предшественников. Этот маркер, по-видимому, высококонсервативен среди видов млекопитающих. Экспериментальные данные свидетельствуют о том, что CD34 может участвовать в адгезии гемопоэтических клеток к стромальным клеткам в микросреде костного мозга. Однако совсем недавно были идентифицированы CD34-негативные HSC, называемые клетками боковой популяции (SP). Клетки SP считаются одними из самых примитивных HSC из-за их высокого пролиферативного потенциала и чрезвычайной эффективности в возвращении к местам кроветворения при инъекции мышам-реципиентам. Таким образом, экспрессия CD34 на HSC может быть связана со степенью активации этих клеток, причем CD34-негативные клетки являются наиболее примитивными и покоящимися.
Антиген стволовых клеток
Антиген стволовых клеток-1 (Sca-1) — это белок клеточной поверхности, часто используемый для идентификации мышиных HSC. Эта молекула может играть роль в определении линий???.
Отток красителя
Способность некоторых примитивных HSC выделять флуоресцентный краситель позволяет идентифицировать эту популяцию, называемую SP-клетками, с помощью проточной цитометрии. Эта способность, по-видимому, обусловлена увеличением количества или активности мембранных насосов (например, АТФ-связывающего кассетного транспортера [ABC-транспортера]), гипотеза, подтверждаемая обнаружением блокады оттока красителя препаратом верапамил, известным ингибитором этих оттокных насосов. Клетки SP не экспрессируют CD34 и описаны у многих видов. Как указывалось ранее, предполагается, что эти CD34-отрицательные клетки являются одними из самых примитивных HSC.
c - Kit
c - Kit — это трансмембранный тирозинкиназный рецептор, обнаруженный на HSC многих видов. Он связывает лигандный фактор стволовых клеток (SCF, также называемый фактором Steel) и играет важную роль в поддержании, пролиферации и дифференцировке HSC.
Lin
В дополнение к присутствию определенных маркеров (например, CD34, c - Kit, Sca - 1), отсутствие маркеров, присутствующих на дифференцированных клетках, использовалось для выделения и очистки HSC. Отрицательная по линии дифференцировки (Lin − ) классификация обычно означает, что клетки являются отрицательными по комбинации от 6 до 14 различных маркеров дифференцировки зрелых клеток крови.
Факторы транскрипции
Были идентифицированы факторы транскрипции, которые, по-видимому, играют важную роль в регуляции плюрипотентности стволовых клеток и их недифференцированного состояния. Наиболее примечательными являются факторы транскрипции Oct-4, Nanog и Sox-2, которые используются в качестве маркеров эмбриональных и взрослых стволовых клеток.
СТВОЛОВЫЕ КЛЕТКИ, ПОЛУЧЕННЫЕ ИЗ КОСТНОГО МОЗГА
БИОЛОГИЯ СТВОЛОВЫХ КЛЕТОК
Регуляция выживания и плюрипотентности
Ниша
Концепция ниши важна для обсуждения выживания и дифференциации стволовых клеток. Ниши — это локальные тканевые микросреды, функция которых — поддерживать, сохранять и регулировать стволовые клетки. Эти микроокружения обнаруживаются в различных тканях по всему организму, например, в области выпуклости волосяного фолликула, около основания крипт в желудочно-кишечном тракте и, в случае HSC, рядом с эндостом и синусоидами костного мозга. Регуляция стволовых клеток их нишей осуществляется посредством физического контакта и межклеточных взаимодействий с соседними клетками, а также выработки растворимых факторов. Данные также указывают на то, что стволовые клетки обладают способностью влиять на клеточные элементы своей ниши. Например, HSC мышей, подвергшихся острому гемопоэтическому стрессу, обладают повышенной способностью направлять мезенхимальные клетки костного мозга в сторону остеобластической дифференцировки в результате действия костных морфогенетических белков (BMP), полученных из HSC.
Молекулярные механизмы
Какие факторы заставляют стволовые клетки идти по пути самообновления и оставаться недифференцированными по сравнению с прогрессированием в сторону дифференциации линий и фенотипов зрелых клеток? Ответ на этот вопрос постоянно развивается по мере выяснения конкретных молекулярных механизмов. В эмбриональных стволовых клетках мышей выявлено несколько факторов, важных для поддержания выживания, самообновления и плюрипотентности стволовых клеток. Эти факторы делятся на внешние факторы (например, цитокины) и внутренние факторы (например, факторы транскрипции).
Фактор ингибирования лейкемии (LIF) LIF — это цитокин класса интерлейкина (IL) 6, который предотвращает дифференциацию эмбриональных стволовых клеток мышей в культуре. Связывание LIF с его мембранным рецептором приводит к активации множества сигнальных путей, таких как Янус-киназа/трансдукторы сигнала и активаторы транскрипции (JAK/STAT), фосфоинозитид-3-киназа (PI3K) и киназы, связанные с внеклеточным сигналом (ERK). Хотя эти пути являются общими нисходящими сигналами многих цитокинов, в данном контексте их активация, как правило, способствует поддержанию самообновления и плюрипотентности. Однако в этом примере активация ERK, по-видимому, способствует дифференцировке эмбриональных стволовых клеток мышей. Таким образом, LIF может активировать сигналы, которые либо способствуют, либо препятствуют поддержанию недифференцированного состояния, и именно баланс между этими нисходящими эффектами (обычно благоприятствующими самообновлению и плюрипотентности) определяет результат.
Костный морфогенетический белок 4 (BMP 4) и основной фактор роста фибробластов (FGF). BMP4 и основной FGF являются дополнительными примерами внешних факторов, которые способствуют самообновлению и плюрипотентности эмбриональных стволовых клеток мышей. В случае BMP4 он, по-видимому, работает в синергетическом состоянии с LIF. Вероятно открытие дополнительных сигнальных путей и факторов, поскольку факторы, важные для эмбриональных стволовых клеток мышей, не универсальны при применении к эмбриональным стволовым клеткам человека.
Wnt Были идентифицированы специфические внешние факторы, участвующие в самообновлении HSC. Сигнальный путь Wnt стимулирует самообновление HSC, одновременно подавляя дифференцировку HSC. Индукция активации β-катенина, нисходящего компонента сигнального пути Wnt, приводит к усилению самообновления мышиных HSC и ограничивает дифференциацию этих клеток. При добавлении ингибиторов пути Wnt к мышиным HSC и факторам роста пролиферация HSC подавляется.
Тирозинкиназа с доменами 2, подобными иммуноглобулину и эндотелиальному фактору роста (Tie2), и ангиопоэтин-1. Сигнализация Tie2/ангиопоэтина-1 также участвует в выживании HSC. Tie2 — это рецепторная тирозинкиназа, экспрессирующаяся на некоторых HSC. Ангиопоэтин-1 является лигандом рецептора Tie2 и способствует покою и повышению адгезии мышиных HSC к стромальным клеткам костного мозга. Считается, что регуляция состояния покоя и поддержание его в нише HSC важны для выживания HSC за счет защитного эффекта от миелосупрессивных стрессов.
Другие цитокины К другим цитокинам, важным для регуляции выживания HSC, относятся SCF, тромбопоэтин (TPO), BMP, FGF, инсулиноподобный фактор роста 2 (IGF-2) и интерлейкин (IL)-10. SCF и TPO являются общими компонентами большинства комбинаций цитокинов, используемых при культивировании и размножении HSC. Хотя TPO является основным цитокином, участвующим в образовании мегакариоцитов и тромбоцитов, было также показано, что он оказывает значительное воздействие на HSC. In vitro TPO способствует выживанию и размножению HSC, а у мышей, генетически измененных с целью отсутствия TPO или его рецептора, наблюдается значительно меньше стволовых клеток.
Факторы транскрипции Внутренние факторы, регулирующие недифференцированное состояние эмбриональных стволовых клеток, состоят в основном из факторов транскрипции. Наиболее примечательными являются Oct-4, Nanog и Sox-2. Эти факторы обнаружены в плюрипотентных клеточных линиях, и, как правило, их подавление приводит к дифференциации стволовых клеток. Присутствие Oct-4 и Sox-2, по-видимому, необходимо для плюрипотентности; Однако целевые гены для этих факторов транскрипции еще полностью не охарактеризованы. Также были описаны несколько факторов транскрипции и регуляторов клеточного цикла, управляющих самообновлением HSC.
Микрорибонуклеиновые кислоты (mi RNA) mi RNA представляют собой дополнительный внутренний молекулярный механизм, предположительно участвующий в поддержании плюрипотентных стволовых клеток. miRNA — это короткие одноцепочечные молекулы РНК, которые регулируют функцию генов, подавляя трансляцию посредством отжига, а иногда и деградации мРНК. Обнаружены новые miRNA, которые, по-видимому, преимущественно экспрессируются в недифференцированных эмбриональных стволовых клетках. Кроме того, оценка профилей экспрессии miRNA из эмбриональных стволовых клеток разной степени дифференцировки, а также из клеток зрелых тканей показывает подавление или потерю специфических микроРНК по мере перехода клеток в более дифференцированное состояние.
Регуляция дифференциацировки
Дифференциация стволовых клеток в определенные линии контролируется или направляется такими факторами, как цитокины, взаимодействие ниш и регуляторы самообновления и плюрипотентности. Цитокины влияют на определение линии стволовых клеток и направляют ее, и многие из них были описаны в контексте дифференцировки гемопоэтических стволовых клеток и клеток-предшественников (рис. 3.2; см. главы 6–11).
Стромальные клетки, составляющие нишу стволовых клеток, влияют на дифференциацию и определение линии посредством физического взаимодействия между клетками и выработки растворимых или связанных с клетками факторов (например, цитокинов). Наконец, как уже было описано ранее, существуют регуляторы, способствующие самообновлению и плюрипотентному состоянию стволовых клеток. Для того чтобы произошла дифференциация, эти регуляторы должны быть ингибированы или подавлены. С точки зрения механизма можно выделить две общие категории, по которым клетки ограничивают приверженность линии. Первый из них включает спектр поверхностных рецепторов, адгезионных белков и сигнальных путей, экспрессируемых данной клеткой. Например, цитокины играют важную роль в развитии клеточных линий. Однако если у стволовой или прогениторной клетки отсутствует рецептор цитокина, то этот цитокин не окажет практически никакого эффекта на свою цель. Подавление генов — это второй механизм, посредством которого может происходить ограничение генетической линии. Для того чтобы клетки дифференцировались, активируются или подавляются определенные гены, направляя клетки в сторону определенной линии. Это может быть достигнуто посредством таких механизмов, как метилирование ДНК и модификация гистонов, которые изменяют транскрипционное состояние хроматина.

ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ СО СТВОЛОВЫМИ КЛЕТКАМИ
Система кроветворения наглядно иллюстрирует последствия отказа стволовых клеток. HSC отвечают за постоянную замену всех клеточных компонентов крови; при недостаточности HSC развиваются цитопении (например, анемия, лейкопения, тромбоцитопения) и связанные с ними клинические проявления (например, летаргия, инфекция, кровотечение). Неудача HSC может быть результатом ряда основных патологических процессов, включая токсическое или лекарственно-опосредованное повреждение, иммуноопосредованное повреждение, инфекционные агенты (например, парвовирус, вирус лейкемии кошек и Ehrlichia spp.), недостаточную стимуляцию цитокинами и факторами роста, а также нарушение или повреждение ниши стволовых клеток (например, миелофтиз, ишемия, воспаление). (См. Раздел II.)
Стволовые клетки и пролиферативные заболевания
Подобно тому, как взрослые стволовые клетки отвечают за замену зрелых клеток и тканей, существуют убедительные доказательства того, что клетки со свойствами стволовых клеток лежат в основе патологии по крайней мере некоторых видов рака. Гипотеза о раковых стволовых клетках основана на нескольких основных наблюдениях. Первым из них является наблюдение за гетерогенностью опухоли. Многие опухоли состоят из клеток с различной морфологией и фенотипом, которые в некоторых случаях отдаленно напоминают исходную ткань. Это предполагает определенную степень дифференциации внутри популяции опухолевых клеток, что приводит к изменчивости структуры и функций. Более примитивная клетка-предшественник (т. е. раковая стволовая клетка) предположительно может дать начало различным фенотипам внутри опухоли. Второе наблюдение заключается в том, что трансплантация опухоли требует относительно большого количества раковых клеток, что свидетельствует о том, что только небольшое количество клеток в данной опухоли обладает способностью образовывать опухоль. Раковые стволовые клетки присутствуют в опухоли в небольшом количестве, поэтому для обеспечения присутствия этих клеток потребовалось бы сравнительно большое количество ткани. Как и обычные стволовые клетки, раковые стволовые клетки обладают основными функциональными свойствами самообновления и способностью к дифференциации.
У людей доказательства наличия раковых стволовых клеток были получены при раке кроветворной системы, головного мозга, молочной железы, толстой кишки, предстательной железы, костей и яичников, а также имеются некоторые доказательства существования раковых стволовых клеток у животных. Подтверждение существования раковых стволовых клеток у человека заключается в идентификации подгруппы опухолевых клеток, которые экспрессируют маркеры стволовых клеток и обладают исключительной или повышенной способностью образовывать опухоли in vitro или in vivo. Существуют данные, что раковые стволовые клетки могут возникать из нормальных стволовых клеток и/или клеток-предшественников, которые приобрели способность к самообновлению. Происхождение раковых стволовых клеток продолжает изучаться.
Существование раковых стволовых клеток имеет очевидные последствия для понимания биологии рака и лечения, по крайней мере, некоторых видов рака. Например, многие химиотерапевтические препараты воздействуют на быстро делящиеся клетки. Однако раковые стволовые клетки относительно медленно делятся, что позволяет им выживать при использовании традиционных методов лечения. Для эффективного лечения этих типов неоплазий будут важны новые терапевтические методы, направленные на устранение раковых стволовых клеток.
Сокращения и аббревиатуры
ОПРЕДЕЛЕНИЕ И ИСТОРИЯ
На сегодняшний день определено более 339 молекул CD. Этот взрывной рост числа молекул CD является результатом использования методов молекулярной биологии для идентификации новых молекул. Целью данной главы является предоставление наиболее актуального списка антигенов CD, распознаваемых различными антителами у животных ветеринарного направления. В таблице 4.1 обобщены современные знания о важных ветеринарных антигенах CD, включая клоны MAb, которые реагируют с антигенами CD собак, кошек, жвачных животных (крупного рогатого скота, овец и коз), свиней и лошадей; относительный(е) размер(ы) молекулы; топология в мембране; распределение в тканях; известная физиология; и видовая реактивность моноклональных антител. Включены избранные ключевые ссылки для каждого антигена CD.
Более подробная информация о молекулах CD, описанных в настоящее время, доступна на нескольких веб-сайтах, включая таксономическую ключевую программу, поддерживаемую Университетом штата Вашингтон, которая разработана для предоставления информации о конкретном городе моноклональных антител, специфичных для молекул лейкоцитарной дифференцировки внутри видов и между видами (http://www.vetmed.wsu.edu/tkp/). На этом сайте имеются ссылки на коммерческие компании, которые являются основными поставщиками ветеринарно-специфических моноклональных антител, включая Serotec (http://www.ab-direct.com/antibodies/_-500.html ) и Veterinary Medical Research & Development (VMRD). Международный обзор белков в Интернете (PROW) ( http://mpr.nci.nih.gov/prow/ ) предоставляет исчерпывающую базу данных с полным перечнем антигенов CD и ссылками на первичные последовательности нуклеиновых кислот и белков человеческих антигенов CD.

СТРУКТУРА И ИНТЕГРАЦИЯ МЕМБРАННЫХ АНТИГЕНОВ
ТРАНСМЕМБРАННЫЕ БЕЛКИ
Трансмембранные белки типов I и II имеют только одну трансмембранную α-спираль, содержащую 20–25 гидрофобных аминокислот. Белки типа I имеют N-концевую сигнальную последовательность эндоплазматического ретикулума (ER), которая расщепляется после того, как молекула попадает в ER. Это наиболее распространенный способ интеграции мембраны среди антигенов CD, перечисленных в таблице 4.1. Белок гликозилируется в аппарате Гольджи, если у белка есть сайт гликозилирования, а затем экспрессируется на поверхности клетки. Белки типа I закреплены в мембране таким образом, что их гидрофильный N-концевой участок находится на экзоплазматической стороне, а их гидрофильный C-концевой участок — на цитоплазматической стороне. Эти белки обычно представляют собой рецепторы и/или лиганды клеточной поверхности (например, CD4), многие из которых принадлежат к суперсемейству иммуноглобулинов (Ig).
Однопроходный трансмембранный белок типа II (II)
Трансмембранные белки типа II не имеют расщепляемой сигнальной последовательности ER и ориентированы таким образом, что их гидрофильный С-конец находится на экзоплазматической стороне, а гидрофильный N-конец — на цитоплазматической стороне. Эти белки имеют внутренний гидрофобный сигнал ER и мембранную якорную последовательность. Поскольку эти белки могут высвобождаться с поверхности клетки, они также могут действовать как плазменные белки, оказывая физиологическое воздействие на клетки, несущие контрлиганды. 1 CD13 — цинксвязывающая металлопротеаза, которая облегчает презентацию антигена путем отщепления N-концевых аминокислот от пептидов, связанных с MHC класса II, — является примером белка типа II.
Многопроходный трансмембранный белок (III)
Трансмембранные белки типа III пересекают мембрану многократно (2, 3, 4, 5, 7 или 12) раз и также называются тетраспанинами. Наиболее часто встречающиеся тетраспанины включают те, которые пронизывают мембрану четыре и семь раз. Структурные исследования показывают, что трансмембранные области представляют собой альфа-спирали. Если белок типа III имеет четное число трансмембранных альфа-спиралей, его N- и C-концы ориентированы к одной и той же стороне мембраны. Многие из этих молекул клеточной поверхности функционируют как рецепторы для растворимых молекул, таких как простагландины и хемокины. Примерами семи трансмембранных белков типа III являются рецептор интерлейкина-8 (ИЛ-8) (CD128) и рецептор C5a (CD88). CD9 является примером четырехпроходного трансмембранного белка. 1 CD47 — пример белка типа III с пятью трансмембранными последовательностями. Транспортный белок множественной лекарственной устойчивости MDR-1 (CD243) имеет 12 трансмембранных участков.
Трансмембранный белок Gpi (V)
Трансмембранные белки типа V используют GPI-якоря, прикрепленные к C-концевому остатку белка. Молекулы с GPI-якорем имеют на N- и C-конце последовательность сигнала секреции, которая расщепляется и заменяется GPI-якорем после синтеза молекулы и входа в ER. Примером GPI-связанного гликопротеина является поверхностный белок CD14, участвующий в очистке организма от грамотрицательных патогенов, связанный с белком, связывающим липидный полисахарид (рис. 4.1). Другими примерами GPI-связанных гликопротеинов являются CD56 и CD90.
Этот маркер часто используется для дифференциации острых незрелых лейкозов лимфоидного или миелоидного происхождения от хронического лимфолейкоза или лейкемических стадий лимфомы. К поверхностным антигенам С-клеток, специфичным для определенной линии и полезным для определения линий лейкоцитарных клеток, относятся CD3, который экспрессируется исключительно на зрелых Т-клетках, а также CD79 α и β, которые являются частью рецептора поверхностного антигена В-клеток. К поверхностным антигенам, не связанным с рестрикцией линий, относятся такие антигены, как CD45, который обнаруживается во всех линиях лейкоцитов (миелоидных и лимфоидных). Хотя последнее исследование CLAW проводилось в 1993 году, оно стало важным совместным проектом, поскольку у собак была выявлена аномальная экспрессия антигена CD4, у которых высокая плотность CD4 наблюдается на нейтрофилах в дополнение к Т-хелперам. 34 Многие другие различия в экспрессии антигена CD являются уникальными среди домашних животных по сравнению с людьми (например, высокая экспрессия рецептора γ δ T-клеток у свиней и жвачных животных5,36 и совместная экспрессия CD4 и CD8 на зрелых T-клетках у свиней).

Сокращения и аббревиатуры
Гемопоэтические стволовые клетки
Приверженность линии обычно следует за экспрессией факторов транскрипции, ограничивающих линию (таблица 5.1). Индукция этих факторов транскрипции происходит посредством комбинации специфических взаимодействий рецепторов и лигандов цитокинов, менее специфических путей передачи сигнала и наложения высокоспецифичных, пермиссивных влияний микросреды со стороны стромальных клеток, эндотелиальных клеток, адипоцитов, остеобластов, белков ECM, адгезивных цитокинов и трабекулярной кости.

На основе экспериментов in vivo на мышах сложилась несколько запутанная номенклатура, посвященная ранним детерминированным гемопоэтическим клеткам-предшественникам. Колонии в селезенке, которые появляются у летально облученных мышей, восстановленных с помощью HSC, называются колониеобразующими клетками в селезенке (CFC-Ss), которые имеют ограниченную способность к самообновлению. Неизвестно, встречаются ли подобные клетки у других видов, поскольку CFC-S определяются специфическими экспериментальными условиями на мышах.

Гематопоэтические предшественники и прекурсоры
В правой части рисунка 5.1 клонигенные типы клеток предположительно не обладают способностью к самогенерации. Однако зрелые типы клеток, такие как макрофаги и тучные клетки, могут обладать существенными свойствами самогенерации. Первоначальная модель кроветворения не включала в себя понятие пластичности. В современной модели концепция пластичности предполагает, что точность линии и прогрессивное ограничение пролиферативной способности в традиционной модели не являются абсолютными. Пластичность рассматривается как свойство как пролиферации, так и приверженности линии. То, как регулируется пластичность в физиологических и патологических условиях, изучено недостаточно. Однако ясно, что ни HSC, ни любой из олигопотентных предшественников не обладают неограниченной способностью к самовоспроизведению, которой обладают эмбриональные стволовые клетки.
Видовая специфичность гемопоэза
Между кроветворением человека и мышей существуют определенные существенные различия. Человеческие HSC экспрессируют Flt3, тирозинкиназный рецептор для лиганда FLT3, тогда как мышиные HSC этого не делают. Однако общие предшественники лимфоцитов (CLP) как у мышей, так и у человека экспрессируют Flt3. Такие различия важны, поскольку некоторые острые миелоидные лейкозы человека связаны с конститутивной активацией Flt3. Потенциальная полезность терапии препаратами, ингибирующими Flt3-киназу, зависит от того, проявят ли другие виды подобные мутации. Хотя иерархические отношения, наблюдаемые в кроветворении мышей, в целом сохраняются и у других видов (рис. 5.1), экспрессия ряда поверхностных антигенов на каждой стадии развития у мышей и людей различна, и эти и другие различия могут встречаться и у других видов. Однако были также выявлены и важные сходства. На основании последних данных молекулярно-генетического понимания циклической нейтропении у серых колли и циклического кроветворения у людей некоторые особенности кроветворения кажутся схожими. Например, аллометрическое масштабирование правильно предсказывает гранулопоэтическую цикличность у мышей (3 дня), собак (14 дней), людей (19–21 день) и слонов (60 дней).
